Künstliche Iris von HumanOptics erhält FDA-Zulassung
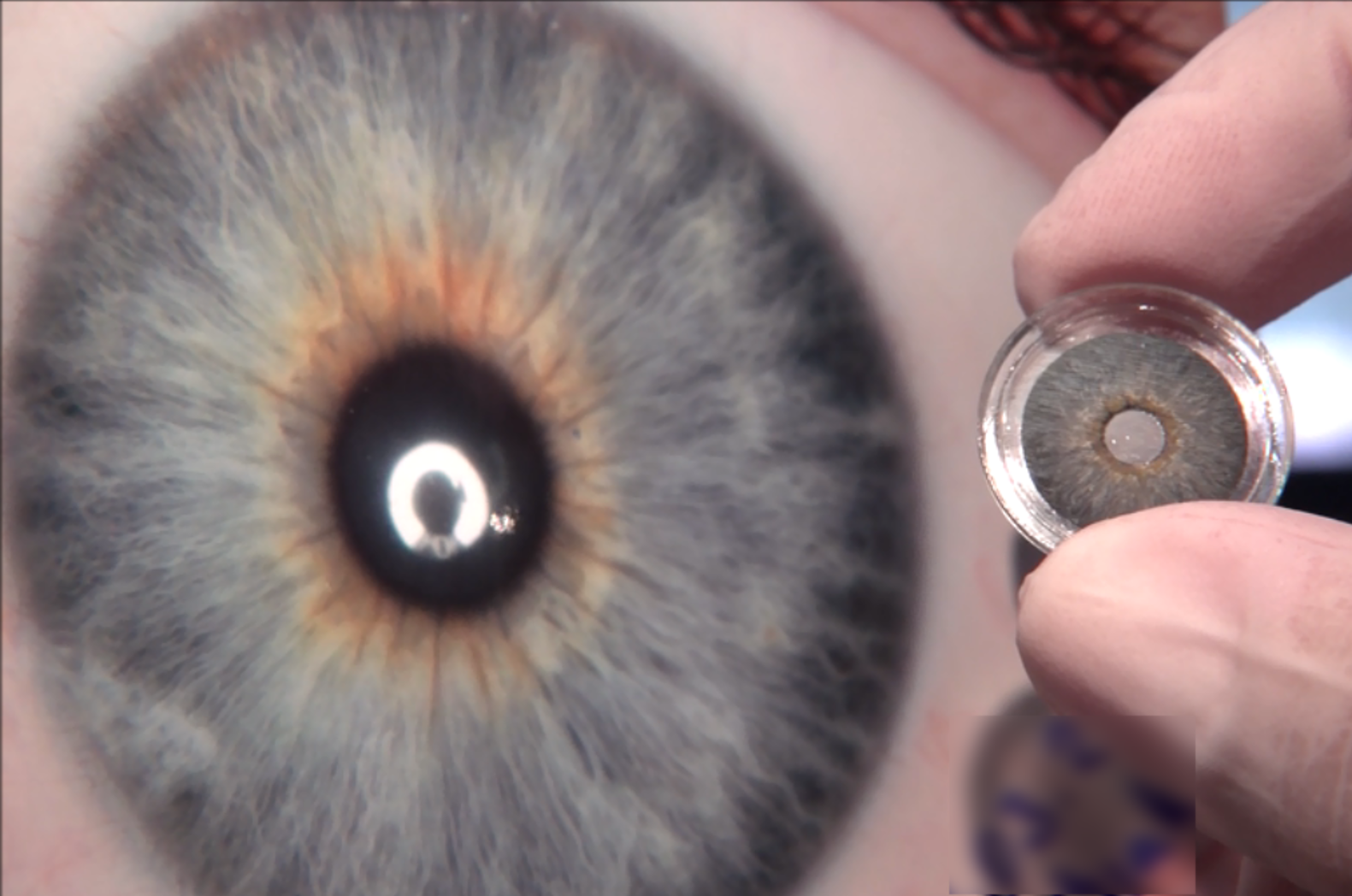
Die künstliche Iris CUSTOMFLEX® ARTIFICIALIRIS der HumanOptics AG hat ihre FDA-Zulassung erhalten. Damit ist dies derzeit das einzige derartige Produkt, das im hochattraktiven US-amerikanischen Markt zugelassen ist und den dort bisher nicht abgedeckten medizinischen Bedarf adressiert.
Dr. Pierre Billardon, Vorstandsvorsitzender der HumanOptics AG, freut sich sehr über den Zulassungsbescheid: „Bei unserem individuell angefertigten Iris-Implantat handelt es sich um ein einzigartiges Produkt mit einem außergewöhnlich hohen Patientennutzen. Deshalb wurde unsere ARTIFICIALIRIS am 1. Dezember 2017 in das Breakthrough Devices Program der FDA aufgenommen. Nur wenige Monate später ist jetzt schon die Zulassung da. Damit ist dies derzeit das einzige derartige Produkt, das im hochattraktiven US-amerikanischen Markt zugelassen ist und den dort bisher nicht abgedeckten medizinischen Bedarf adressiert.“
Mit der ARTIFICIALIRIS werden Patienten behandelt, die ihre Iris durch einen Unfall teilweise oder vollständig verloren haben oder von Geburt an keine Iris besitzen. Die Erkrankung ist für Patienten unter anderem in ihrem sozialen Alltag sehr belastend . Zudem ist sie oft mit einer ganzen Reihe weiterer medizinischer Indikationen wie erhöhter Lichtempfindlichkeit, Sehkraftverlust oder dem überdurchschnittlichem Risiko des Bildens von grünem und grauem Star (Glaukom und Katarakt) verbunden.
Jede ARTIFICIALIRIS wird von HumanOptics individuell dem ursprünglichen Erscheinungsbild der Iris des Patienten nachempfunden. Sie besteht aus einem flexiblen Silikonmaterial, das mittels Kleinschnitttechnik – und damit gut verträglich – in das Auge eingebracht wird. Damit wird sowohl die medizinische als auch die ästhetische Versorgung der Patienten gewährleistet und so eine sehr hohe Zufriedenheit erreicht.
Innerhalb des sehr spezialisierten Marktes für Augenchirurgie in den USA hat sich die HumanOptics AG bereits eine hohe Reputation erarbeitet: Im Rahmen einer 2013 begonnenen medizinischen Studie wurden in den USA schon mehr als 600 erfolgreiche Operationen an 12 Kliniken durchgeführt. Das Marktpotenzial für unser Produkt liegt bei rund 150 Kliniken und bei 1.000 bis 1.500 Patienten pro Jahr.
Dr. Billardon rechnet daher bei diesem Produkt mit einem hohen Umsatz - und Ertragspotenzial: „Wir gehen davon aus, dass sich die künstliche Iris mittelfristig zu einem bedeutenden Standbein unserer Gesellschaft entwickelt. Bei vielen unserer heutigen Operateure gibt es bereits Wartelisten mit Patienten, die unsere künstliche Iris benötigen, jedoch im Rahmen der Studie nicht behandelt werden konnten. Zusätzlich zu dem erheblichen Marktpotenzial in den USA wird die FDA -Zulassung auch auf unsere europäischen Märkte, in denen wir das Produkt heute auch schon anbieten dürfen, positiv abstrahlen.“
Hier gehts zur Pressemeldung der amerikanischen Zulassungsbehörde FDA.





